 |
Die Küvette (Abbildung 4) besteht aus Teflon. Zwei
Abteilungen sind durch eine 1mm dicke Wand getrennt. Jede Abteilung hat ein
Volumen von ca. 6ml. Da die gesamte Küvette aus einem Block hergestellt
wurde, gibt es keine Leckströme wie bei zusammengesetzten Meßzellen. Die dem
Mikroskop zugewandte Abteilung ist mit einem Quarzglasfenster
abgeschlossen. In der Mitte der Trennwand befindet sich die Bohrung, über der
die Lipidmembran hergestellt wird. Bis ca. 100![]() m vor dem Durchbruch auf
die andere Seite ist sie als Zylinderbohrung des Durchmessers 1,5mm
ausgeführt. Dann wurde mit einem Kugelkopfbohrer weitergearbeitet. Dadurch
entstand ein Loch mit 0,75mm Durchmesser und extrem dünnen Rändern.
m vor dem Durchbruch auf
die andere Seite ist sie als Zylinderbohrung des Durchmessers 1,5mm
ausgeführt. Dann wurde mit einem Kugelkopfbohrer weitergearbeitet. Dadurch
entstand ein Loch mit 0,75mm Durchmesser und extrem dünnen Rändern.
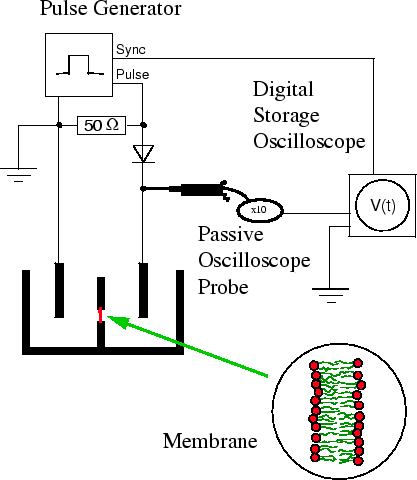
Als kleinste Ausgangsspannung des Pulsgenerators sind 500mV
angegeben. Benötigt wird der Bereich von 20 bis 600mV. Deshalb ist vor die
Diode ein 20dB Abschwächer geschaltet. Mit seinem 50![]() Abschlußwiderstand gegen Masse garantiert er nach BNC-Spezifikation die
korrekte Übertragung des Signals vom Pulsgenerator und das schnelle Aufladen
der Membran.
Abschlußwiderstand gegen Masse garantiert er nach BNC-Spezifikation die
korrekte Übertragung des Signals vom Pulsgenerator und das schnelle Aufladen
der Membran.
Erste Tests wurden mit Kondensatoren an Stelle der Meßzelle
durchgeführt. Mit 1nF lag deren Kapazität im Bereich der Kapazität der zu
untersuchenden Membranen. Kapazitätsmessung mit der Ladungspulsmethode (siehe
Abschnitt 3.9) bei einem 100pF Kondensator ergaben Werte, die
14pF über den Meßwerten des Impedanzanalysators lagen. 14pF entsprechen der
Kapazität der passiven Probe des Oszilloskopes. Von anderen Gruppen werden
einfache Operationsverstärker zur Einkopplung des Oszilloskopes in den
Meßkreis verwendet. Das Meßsignals wird verstärkt. Man erhält ein besseres
Signal zu Rausch Verhältnis. Hoher Eingangswiderstand bedingt aber niedrige
Grenzfrequenz des Operationsverstärkers und damit Verfälschungen bei hohen
Frequenzen. Große Anstiegszeiten verdecken wichtige Informationen schneller
Prozesse. Zum Erreichen von Eingangswiderständen über 10M![]() oder zum
Treiben des 50
oder zum
Treiben des 50![]() Eingangs des Oszilloskopes habe ich auf
Operationsverstärker zurückgegriffen.
Eingangs des Oszilloskopes habe ich auf
Operationsverstärker zurückgegriffen.
Von ca. 8cm Silberdraht, Durchmesser 1mm, werden einige cm auf eine
Holzschraube gewendelt. Oxidschichten sind vorher zu entfernen. Zur Reinigung
mehrere vorbereitete Stücke 20min in NH![]() conc. kochen. Danach gut mit
destilliertem Wasser spülen. Nach 20s Ätzen in HNO
conc. kochen. Danach gut mit
destilliertem Wasser spülen. Nach 20s Ätzen in HNO![]() conc. sofort
beschichten. Dafür bereitet man 0,01M HCl vor. Als Gegenelektrode im
Galvanisierprozeß dient gewendelter Platindraht mit eingefügtem 1k
conc. sofort
beschichten. Dafür bereitet man 0,01M HCl vor. Als Gegenelektrode im
Galvanisierprozeß dient gewendelter Platindraht mit eingefügtem 1k![]() Widerstand. Zur weiteren Reinigung 20s Pt+/Ag-, ca. 20mA, Chlorierung 20-25min
Pt-/Ag+, 6mA. Die Lösung sollte während der Beschichtung gerührt
werden. Der Vorgang wird beendet, wenn alle Elektroden gleichmäßig grau
belegt sind. Die Silberdrähte sind während der Prozedur gegebenenfalls
mehrmals zu wenden. Danach kann man die Elektroden füer 30h in 0,01M HCl im
Dunkeln altern.
Widerstand. Zur weiteren Reinigung 20s Pt+/Ag-, ca. 20mA, Chlorierung 20-25min
Pt-/Ag+, 6mA. Die Lösung sollte während der Beschichtung gerührt
werden. Der Vorgang wird beendet, wenn alle Elektroden gleichmäßig grau
belegt sind. Die Silberdrähte sind während der Prozedur gegebenenfalls
mehrmals zu wenden. Danach kann man die Elektroden füer 30h in 0,01M HCl im
Dunkeln altern.
Dieses Lipid ist in einem weiten Bereich um die Raumtemperatur herum in der fluiden Phase. Es wird synthetisiert und liegt in hoher Reinheit vor. Chemische Stabilität und Gehalt an Fremdstoffen wurden von Jos Brouwers (Universität Utrecht) untersucht. Eine Probe neu gekauften Lipides und eine Probe von mir während eines Jahres gebrauchten Lipides verglich er an seiner HPLC-Anlage (Abbildungen 6 und 7).
Das Lipid mußte für die Untersuchung aufbereitet werden. Im ersten Schritt wurde es derivatisiert. Danach betrachtet er das zeitliche Erscheinen von Komponenten nach einer vorgegebenen Wegstrecke über die HPLC-Säule Merck RP18. Unterschiedliche Bestandteile haben unterschiedliche Laufzeiten.
Auf der Zeitachse vor 5min liegt Derivat ohne Fettsäureanteile. Bei 20min liegt ein Peak von Fettsäuren mit 1 oder 2 fehlenden Methylgruppen. Alle anderen Unreinheiten sind eher auf das Decan zurückzuführen, lassen sich jedenfalls nicht genau aufschlüsseln. Nach diesen Untersuchungen haben wir ein Decan verwendet, das als Fluoreszensstandart zugelassen war (Fluka).
In [19] wird eine Methode beschrieben, Actinmonomere an einer
Membranoberfläche zu polymerisieren. Dabei interagiert Actin direkt mit
positiv geladenen Lipiden. Die Menge polymerisierten Actins ist proportional
zur Oberflächendichte der positiven Ladungen. Als Mischung zur Herstellung
der Membran benutzten wir 90% DPh-PC, 10% Stearylamine in
Decan. Stearylamine ist der Trivialname von Octadecylamine,
![]() . Bei höheren Zusätzen von Stearylamine werden die
in [19] verwendeten Liposome instabil, so daß keine
aussagekräftigen Vergleichswerte vorliegen.
. Bei höheren Zusätzen von Stearylamine werden die
in [19] verwendeten Liposome instabil, so daß keine
aussagekräftigen Vergleichswerte vorliegen.
Die Versuche mit Actin wurden wie in
den Abschitten 3.8 und 3.9 beschrieben
durchgeführt. Als Elektrolyt verwendete ich die in Abschitt 3.6
vorgestellte Lösung. Nach mehrmaliger Kapazitätsmessung gab ich wenige ![]() l
Actinstammlösung in eine Abteilung der Küvette. Die Actinkonzentration in
dieser Abteilung betrug 88nM. Ohne zu rühren diffundierten die Actinmonomere
an die Membran. Durchbruchsmessungen führte ich nach einer halben Stunde
Wartezeit aus.
l
Actinstammlösung in eine Abteilung der Küvette. Die Actinkonzentration in
dieser Abteilung betrug 88nM. Ohne zu rühren diffundierten die Actinmonomere
an die Membran. Durchbruchsmessungen führte ich nach einer halben Stunde
Wartezeit aus.
Glaswaren und Küvette wurden bei Wechsel des Lipids mit DMSO
ausgewaschen. Zur täglichen Reinigung und nach der Behandlung mit DMSO
spülte ich die Arbeitsmittel mehrmals abwechselnd mit destilliertem Wasser
und Ethanol. Bis zum nächsten Gebrauch lagerten Glaspipetten, Probengläschen
und Meßbecher bei 130![]() C im Trockenschrank. Zur Auftragung der
Lipidlösung zum Vorbereiten der Meßzelle (siehe
Abschnitt 3.8) verwendete ich Hamiltonspritzen. Diese
wurden mit Decan und Ethanol gespült. Die Küvette wurde vor den Versuchen
für zweimal eine halbe Stunde mit destilliertem Wasser
gefüllt. Oberflächenaktive Stoffe sammeln sich an der
Wasser-Luft-Grenzfläche und können abgeschüttet werden.
C im Trockenschrank. Zur Auftragung der
Lipidlösung zum Vorbereiten der Meßzelle (siehe
Abschnitt 3.8) verwendete ich Hamiltonspritzen. Diese
wurden mit Decan und Ethanol gespült. Die Küvette wurde vor den Versuchen
für zweimal eine halbe Stunde mit destilliertem Wasser
gefüllt. Oberflächenaktive Stoffe sammeln sich an der
Wasser-Luft-Grenzfläche und können abgeschüttet werden.
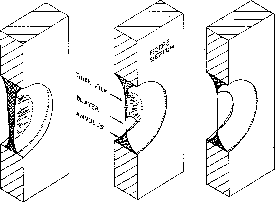
Das Experiment setzt sich aus zwei Teilen zusammen. Kapazitätsmessung und Durchbruch. Nach dem Ziehen der Membran beobachtet man optisch das Ausdünnen des Lipidfilmes. Es bilden sich Newtonsche Farbverläufe aus, wie sie von dünnen Schichten bekannt sind (Abbildung 10).
Während des Ausdünnens auf ca. 6nm, was der Länge zweier Lipidmoleküle mit eingelagertem Decan entspricht [11], kommt es zu destruktiver Interferenz zwischen an der ersten und an der zweiten Wasser-Öl-Grenzfläche reflektiertem Licht. Daher der Name ``Black Lipid Bilayer''.
 |
Nun mißt man mehrmals die Kapazität des Filmes. Dazu lädt man die Membran
mit einem kurzen Spannungspuls auf ca. 70mV, und wertet die Entladungskurve
aus. Um meine Daten mit [18] vergleichen zu können, habe ich mit
Pulslängen von 20![]() s gearbeitet. Die Abhängigkeit des elektrischen
Durchbruchs von der Pulslänge ist in [3] beschrieben. Hat die
Membran ihre größte Kapazität erreicht, erhöht man vorsichtig die
Pulsspannung. In jeder neuen Einstellung pulse ich 7 bis 10 mal. Dabei kommt
es ab einer kritischen Spannung zum Durchbruch.
s gearbeitet. Die Abhängigkeit des elektrischen
Durchbruchs von der Pulslänge ist in [3] beschrieben. Hat die
Membran ihre größte Kapazität erreicht, erhöht man vorsichtig die
Pulsspannung. In jeder neuen Einstellung pulse ich 7 bis 10 mal. Dabei kommt
es ab einer kritischen Spannung zum Durchbruch.
Nach der Datenübertragung auf den Computer (siehe Abschnitt 5.3) können die Kurven ausgewertet werden.